Na melyik tudomány hekkelte be magát a Nobel-díjas felfedezések közé ismét? Az elmúlt 10-20 évet elnézve gyakorlatilag minden évben osztottak olyan Nobel-díjat, amit a kutatók valamilyen módon a molekuláris biológia módszereivel, arra alapozva folytattak vagy konkrétan egy molekuláris biológiai folyamatot tisztáztak.
Mielőtt csukafejest ugranék a molekuláris szintű mechanizmusok tárgyalásában, érdemes megnézni az alábbi videót a jelenség emberi oldaláról, nevezetesen egy kisfilmet a xeroderma pigmentosumról.
Megint más esetben, a Neill-Dingwall-szindrómánál, más nevén Cockayne-szindrómánál ugyanúgy arról van szó, hogy egy örökítőanyagban bekövetkezett hibát nem ismernek fel az erre szakosodott enzimek, persze más típusú hibát, a klinikai kép is teljesen más.
Idén Tomas Lindahl, Paul Modrich és Aziz Sancar a DNS-t érintő hibajavító mechanizmusok és ezek esetleges meghibásodásaik mikéntjének tisztázásáért kaptak Nobel-díjat, azonban nem orvosi-fiziológiait, hanem kémiait, lényegében tényleg minden további nélkül nyerhették volna az egyik és a másik kategóriában egyaránt.
A lényeget fussuk át még egyszer: az élő sejtekben lévő, csigalépcsőként elképzelhető DNS, aminek a lépcsőfokait egymással szemben, párban elhelyezkedő bázisok képzik, a köztük lévő belső kötés az egyik, ami a szerkezetet stabilizálja, a másik stabilizáló kötés pedig a csigalépcső külső vázát adó, cukor-foszfát gerinc egységeket összekapcsoló kötés hosszában. Elmagyarázni sokkal nehezebb, mint mutatni, tehát valahogy így:
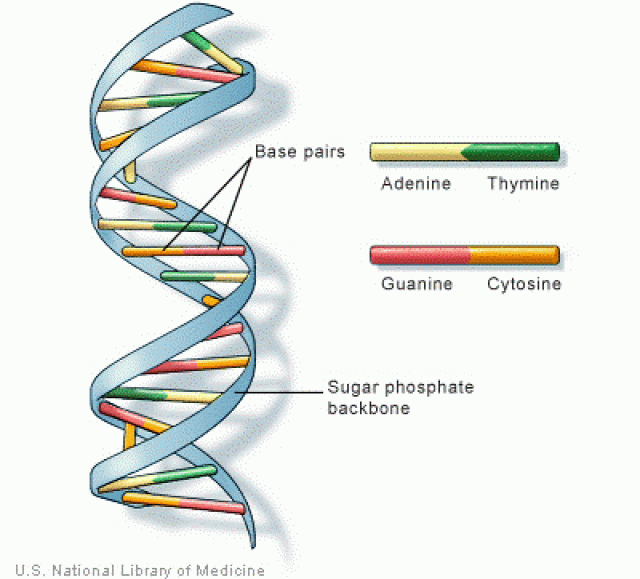
A DNS rendkívül kompakt formában van jelen, de szükség esetén fellazul, majd a szálból a szükséges szakaszról, mint genetikai információt hordozó részről, egyfajta lenyomat készül, ez az RNS. Egy-egy ilyen szakasz feleltethető meg általában egy-egy génnek (transzkripció). Az RNS szálra rákapcsolódik az ún. riboszóma, ami a hordozott információ alapján elkészít egy génterméket, általában fehérjét (transzláció), ami végülis az azonosítható örökletes tulajdonság lesz. Sejtosztódáskor a teljes DNS-ről másolatot kell készíteni, meg kell kettőzni azt, aminek a másodpéldánya az új sejtbe kerül. A molekuláris biológia lényegében ezeknek a folyamatoknak a részleteivel foglalkozik.
Régóta ismert, hogy a transzkripció, a transzláció és a duplikáció részfolyamataiban néha előfordulnak hibák, mégpedig olyan hibák. Persze a könyvekben több külön fejezet foglalkozik azzal, hogy a különböző hibákat hogyan ismeri fel és javítja ki a rendszer, megjegyzem, elképesztő bravúrossággal és pontossággal. Ha ez nem történne meg, a DNS-ünk információtartalma össze-vissza változna a sejtosztódások alkalmával avagy hiába lenne pontos egy-egy génre vonatkozó információ, a géntermék a transzkripció vagy a transzláció hibája miatt végeredményben hibásan jönne létre, összességében igen rövid idő alatt az élettel összeegyeztethetetlen vagy legalábbis nagyon súlyos állapot alakulna ki. A hibajavítási folyamatokat nevezzük repair-nek. Előfordul, hogy a repair bizonyos esetekben nem működik, de általában nem a hibajavító képesség teljes hiányát, csak csökkent működését kell elképzelni.
Meglehetősen szerteágazó témáról van szó és természetesen nem úgy kell elképzelni, hogy három kutató tárta volna fel az összes típusú hibajavító mechanizmust egy az egyben.
Ahhoz, hogy a DNS kellően stabil legyen, bizonyos játékszabályoknak érvényesülniük kell, így például a létraszerű molekulában az adenin bázissal szemben csak timin lehet, míg a citozinnal szemben csak guanin. Abban az esetben, ha ebbe hiba csúszik a DNS elkészítése során, annak egyik közvetlen következménye, hogy a DNS kevésbé lesz stabil, úgy is fogalmazhatnék, hogy a csigalépcső nem a megfelelő módon feszül, másrészt nyilván amikor a leolvasás, RNS-re való átírás történik, hibás információ fog az RNS lenyomatba kerülni, ha pedig a DNS megkettőződésére van szükség, a másolat is hibás lesz. Teljesen érthető, hogy az evolúció a rendszert úgy fejlesztette, hogy a hibákat azonnal észleljék és javítsák az erre specializálódott enzimek. Azaz ha például egy adeninnel szemben a láncban nem timin épül be, hanem bármi más, azt enzimek észlelik, kivágják és beillesztik helyette a megfelelő bázist, ez az ún. bázis-excíziós repair, de előfordul, hogy nem csak a bázist kell lecserélni, hanem a csigalépcső külső gerincét adó cukor-foszfát részt is, ez a nukleotid-excíziós repair. Ez persze még mindig egyszerűsítés, valójában például nem lehetséges egyetlen nukleotidot kivágni, csak egy teljes szakaszt, amihez tartozik, majd a helyére szintetizálni kell egy megfelelő szakaszt a helyes nukleotiddal, ez lényegen nem változtat. (Hivalalos press release erre: http://www.nobelprize.org/nobel_prizes/chemistry/laureates/2015/popular-chemistryprize2015.pdf ) Bizonyos esetekben egy-egy élőlénynél éppen azok az enzimek hiányoznak vagy működnek alul, amiknek a szabást-varrást-stoppolást-hibajavítást kellene normálisan végezniük. Abban az esetben, ha nem az egész életet végigkísérő hibáról van szó, hanem arról, hogy súlyos hiba történik a transzkripció vagy a transzláció folyamatában és azt nem észleli és korrigálja semmi egészséges emberben, egy élő sejtben – ez egyébként igen ritka – a sejt az utolsó pillanatban vagy észreveszi magát, aztán öngyilkos lesz, azaz apoptotizál megint más esetben pedig hibásan működik, osztódik, az utódsejtekbe eleve hibás információ kerül, általában valamilyen daganatos betegséget alakul ki. Persze előfordul olyan is, hogy egyetlen eltévedt bárányból több tízezer sejtből álló kolónia alakul ki, amelyik aztán osztódik, ha kell, ha nem, kedvezőtlen körülményeket kialakítva abban a környezetben, amiben az adott szövet normális sejtjei élnek, a jelenséget az immunrendszer felismeri és a tumoros sejteket kivégzi. Ilyen előfordulhat tehát egészséges embernél is, bizonyos környezeti tényezők viszont fokozzák az esélyét, hogy bekövetkezzen, ilyen tényezők például az UV sugárzás vagy a dohányzással beinhalált kátrány.
Van, akinél már a születéstől fogva a hibajavítás elmarad. Maga a hibajavító funkció nyilván nem pótolható, a betegeket azokkal a betegségekkel kezelik, amik a repair hiányának közvetett következményei.
A posztban látható első videóban konkrétan a DNS szálban emlékeim szerint timin-párosok jönnek létre, amit nem észlel és javít semmi, ennek következtében, az utódsejtekbe is tropa DNS kerül. Márpedig amikor a testet napfény, ilyen módon több UV éri, a timin-dimerek létrejöttének esélye drámaian nő, ezért ha ezt a típusú DNS károsodást semmi sem korrigálja, az súlyos bőrelváltozást okoz, mivel az UV elsősorban annak szöveteit érinti, rosszabb esetben pedig bőrrák alakul ki.
A második videóban bemutatott betegség molekuláris szintű oka, hogy a DNS megkettőződésekor olyan nukleotidok kerülnek egymással szembe, amiknek egyáltalán nem szabadna, azaz eltérnek az A-T, G-C-szabálytól, azonban ez a mismatch javítatlanul marad, normális esetben így történik:
A repair folyamatokat egészen jól, animációs filmekkel bemutató Youtube-csatorna itt érhető el, természetesen az érhetőség kedvéért az ilyen folyamatokról írni vagy épp animációt készíteni csak jelentős egyszerűsítésekkel lehet. Amit vegyünk észre, hogy az önmagában genetikai tulajdonság lehet, hogy egy szervezet genetikailag instabil, másrészt éppen sok esetben a repair alulműködése jelenti az evolúció molekuláris szintű alapját, azon keresztül, hogy utat enged a mutációknak.


 Sophos Naked Security
Sophos Naked Security Securelist
Securelist cyber-secret futurist
cyber-secret futurist I'm, the bookworm
I'm, the bookworm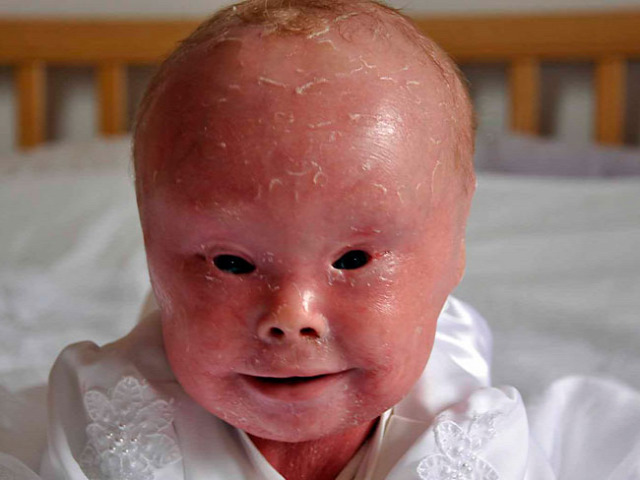
 Augusztusban eléggé erős videót töltöttek fel a 14 éves fiúról, aki egy meglehetősen ritka örökletes betegséggel született, ami miatt a bőre annyira sérülékeny, hogy gyakorlatilag folyamatosan kötözni kell, hogy a helyén maradjon.
Augusztusban eléggé erős videót töltöttek fel a 14 éves fiúról, aki egy meglehetősen ritka örökletes betegséggel született, ami miatt a bőre annyira sérülékeny, hogy gyakorlatilag folyamatosan kötözni kell, hogy a helyén maradjon.