Ugyan az elméleti lehetősége a magzati korban végzett génmódosításnak már jóideje rendelkezésre áll, egy éve próbálkoztak vele egy újszerű, korábbiaknál sokkal ígéretesebb eredménnyel, az örökletes vérzékenység egyik típusának kiküszöbölésére.
A kínai kutatók próbálkozása azonban messze nem volt mindig bombasiker, 80 embrióból mindössze néhánynál volt sikeres a beavatkozás, aminek legvalószínűbb oka, hogy a beépíteni kívánt gén nem tudott beépülni megfelelő módon arra a helyre, ahova szerették volna.
Az októberi IVF-csúcson Washington DC-ben a kutatók egy teljesen más koncepcióval álltak elő, szintén a CRISPR-alapú technika alkalmazásával spermium-őssejtek, azaz spermatogóniumok módosításával próbálkoznak a jövőben, hogy ezekkel a módosított sejtekkel történhessen a megtermékenyítés.
De miért pont az ős-hímivarsejtek?
Számos, teljesen logikus, ráadásul nem is olyan bonyolult érv sorakoztatható fel amellett, hogy miért éppen az éretlen hímivarsejtekre esett a választás. Petesejtből alapvetően jóval kevesebb van, ráadásul őspeték izolálása a hölgyek petefészkéből sokkal körülményesebb lenne.
A hímivarsejtek különböző fázisú őssejtjeiből, ahogy magukból a hímivarsejtekből is viszont szinte számtalan van. A hímivarsejt természetesen nem egyetlen lépésben válik hímivarsejtté egy őssejtből, hanem több szelekciós lépés játszódik le a herékben, ehhez képest még így is akad dupla farokkal, esetleg dupla fejjel vagy egyéb módon a többitől eltérő módon létrejött hímivarsejt, a megtermékenyítésben viszont rendszerint nem ezek lesznek a nyerők.
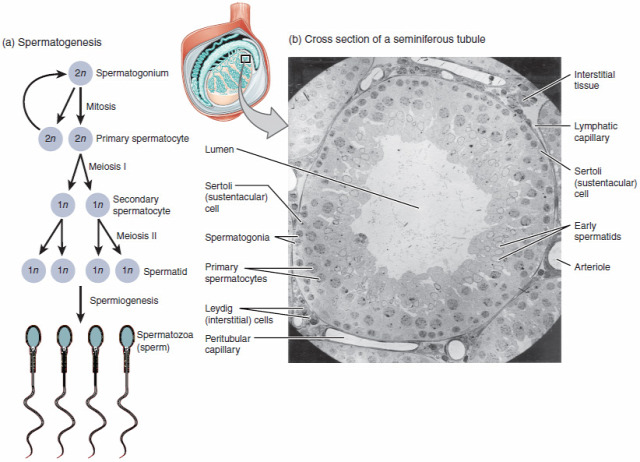
Egy kis "sperma-őssejttan"
A spermiogenezis egy olyan, rendkívül kemény „casting” a természetben, ahol csak a legjobb versenyzőkből lesz egyáltalán hímivarsejt. Az őssejti állapotból, azaz spermatogóniumból egy mitózist követően elsődleges spermatociták lesznek, amik közül a fele marad spermatogónium vagy elpusztul vagy bejut a következő körbe. Ezt követően egy meiózist, azaz már számfelező sejtosztódást követően jönnek létre a másodlagos spermatogóniumok, amiknek egy része szintén elpusztul, amit egy újabb meiózis követ, ahol viszont már nem feleződik a génállományuk, spermatiddá válnak, ezek közül a legéletrevalóbbak válnak tényleges hímivarsejtté, idegen szóval spermatozoává.
Színre lép a genetic engineering új formája
Spermatogóniumból pedig van bőven, ha sikerült beékelni a beillesztendő géneket, természetesen még mindig nem biztos, hogy azok az érett hímivarsejtben is jelen lesznek, viszont igen sok „versenyző” esetén nyilván sokkal nagyobb esély van rá.
Többé-kevésbé köztudott, hogy a sima lombikbébis mesterséges megtermékenyítésnél is több megtermékenyített petesejtet hoznak létre, amiből a legjobbak közül többet is beültetnek a hölgy páciensbe, viszont ezek közül így is csak egy-kettő él túl és fejlődik tovább embrióvá, ergo a gyakorlatban nagyon fontos, hogy – ha szabad így fogalmazni - minél jobb alapanyaggal dolgozzanak az IVF-specialisták.
Az alkalmazás legnagyobb gátja ott, ahol nem is gondolnánk!
A kutatók persze tudják, hogy bizonytalansági tényezők még így is vannak, a legkomolyabb megoldandó problémaként viszont olyan tényezőt tartanak, amire nem is gondolnánk: az ős-hímivarsejtek ki kell nyerni a heréből, amit csak biopsziás módszerrel lehet megoldani, kérdéses viszont, hogy ennek hány férfibeteg veti alá magát a leendő gyermek kedvéért, fájdalomcsillapítás ide vagy oda.
Génterápia régen és most
A konferencia videói mindenki számára elérhetőek. Az embrionális korban végzett, génállományba való beavatkozás csak nagyon indokolt esetben, orvosi céllal engedélyezett. Ahogy írtam, különböző génterápiás eljárások már viszonylag sok ideje rendelkezésre állnak.
Köztük vannak olyanok, amik még megtermékenyítés előtt, az embrionális korban illetve olyanok, amik akár felnőttkorban is alkalmazhatóak egy adott sejttípust megcélozva. A különböző technikák eltérnek a géneket hordozó, DNS-t vagy RNS-t felépítő polinukleotid vagy oligonukleotid szakaszok szállításának, sejtbe való bejuttatásának és sejtmagi DNS-be való beépítésének módjában. A magzati génterápiában a cél lehet az, hogy egészséges génekkel nyomják el olyan gének hatását, aminek a változatai súlyos örökletes betegséget okoznának, míg felnőtt korban nyilván csak adott sejttípus célozható meg. A módszereket mégis igen ritkán alkalmazzák sikerrel, mivel olyan jogi szabályozások vonatkoznak ezekre a módszerekre és az ezzel kapcsolatos alapkutatásokra szintén, mintha azokat a pattintott kőkorban írták volna.
A klasszikus módszerek sem mentesek a nehézségektől
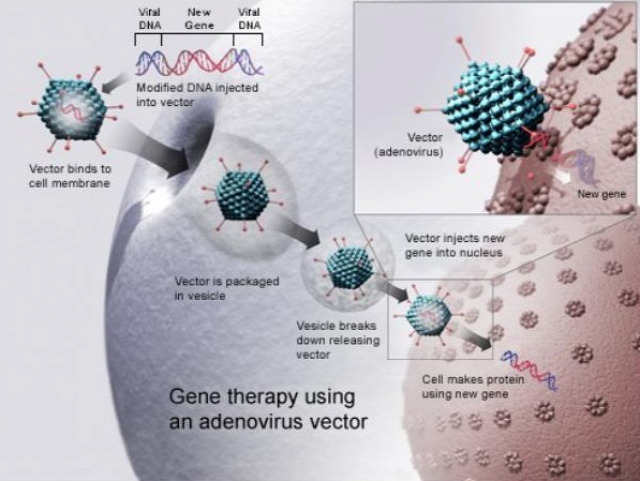
Bármilyen típusú génterápiáról is van szó, komoly kihívást jelent az információhordozó nukleotidszakaszt a célsejtekbe juttatni. Ennek egyik módszere - egyszerűsítve - amikor egy vírust olyan módon alakítanak át, hogy abból a betegséget kialakító örökítőanyagot egy az egyben eltávolítják, ezek helyére pedig a beültetendő gének kerülnek, a kibelezett vírusban viszont azok a részek még megvannak, amik ahhoz szükségesek, hogy sikeresen bejutva a hordozott örökítőanyagot, ami ebben az esetben tehát nem a vírus génjei, hanem a belevarrt, bejuttatandó DNS, a gazdasejt DNS-ébe épülhessen, természetesen több köztes lépésen keresztül.
Ha a beavatkozás ezzel a módszerrel, mondjuk adenovirális hordozóval, azaz virális vektorral történik, még mindig előfordulhat, hogy gyógyító vírusok a bejuttatását követően az immunrendszer lebonthatja. Viszont ha még ha el is éri a célsejteket és sikerül is bejutnia azokba, még mindig nem biztos, hogy a sejt belső védekező mechanizmusai nem gátolják meg, hogy a hordozott nukleotidszakasz helyesen a beteg sejtjeinek DNS-ébe épüljön.
Változatok egy témára - hímivarsejt-szabászat
A CRISPR-alapú technika, egészen pontosan CRISPR-Cas9-módszer lényege egyszerűsítve, hogy egy vágóenzim kivág egy célzott szakaszt az örökítőanyagból, amit a sejt hibajavító mechanizmusai nyomban érzékelnek is, és megkezdik a hibajavítást. A hibajavítás során viszont már nem az eredeti, hanem az átszabott, korrigált géneket hordozó polinukleotid-szakasz illesztik be. A sejtek osztódása, érése során pedig természetesen már az összes ebből létrejövő sejt a helyes változatot fogja hordozni, ha pedig a megtermékenyítés is ezzel történik, nyilván a megtermékenyített petesejt, majd az abból kialakuló magzat sejtjei is a helyes géneket hordozzák majd.
Az alábbi ábra a génterápia azon típusát mututja, amikor virális vektorral juttatják a sejtmagi DNS-be beékelendő polinukleotid-szakasz. [a CRIPSR-cas9-nél nem adenovirális, hanem lentivirális vektort alkalmaznak]
Wikipedia
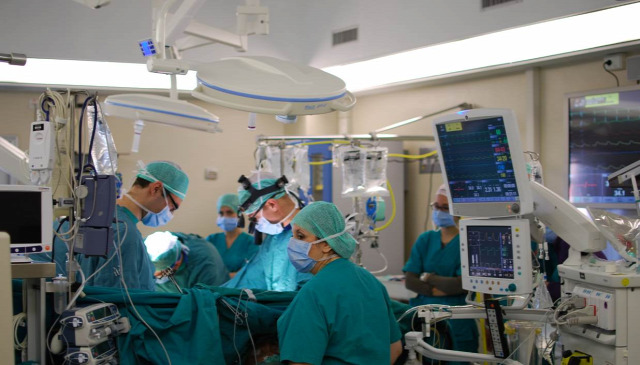 Kicsit későn jutott el hozzám a hír, de úgy fest, hogy nem kacsa: még egy februári szívműtét közben a Merge Hemo, a beteg adatait valós időben monitorozó szoftver nemes egyszerűséggel lefagyott műtét közben, mivel egy nem eléggé elővigyázatosan konfigurált vírusirtó éppen akkor indított egy víruskeresést, ami kiterjedt arra a gépre is, amin a szóban forgó szoftver futott.
Kicsit későn jutott el hozzám a hír, de úgy fest, hogy nem kacsa: még egy februári szívműtét közben a Merge Hemo, a beteg adatait valós időben monitorozó szoftver nemes egyszerűséggel lefagyott műtét közben, mivel egy nem eléggé elővigyázatosan konfigurált vírusirtó éppen akkor indított egy víruskeresést, ami kiterjedt arra a gépre is, amin a szóban forgó szoftver futott.

 Sophos Naked Security
Sophos Naked Security Securelist
Securelist cyber-secret futurist
cyber-secret futurist I'm, the bookworm
I'm, the bookworm